Российские медики обнаружили новую модификацию у семейства белков, защищающих растения от болезней
 Сотрудники Первого Московского государственного медицинского университета имени И.М. Сеченова обнаружили дополнительную химическую модификацию у семейства пептидов, которые обеспечивают одну из ветвей иммунитета растений к грибным болезням, и изучили то, как она влияет на структуру этих белков. Результаты работы опубликованы в журнале International Journal of Molecular Sciences.
Сотрудники Первого Московского государственного медицинского университета имени И.М. Сеченова обнаружили дополнительную химическую модификацию у семейства пептидов, которые обеспечивают одну из ветвей иммунитета растений к грибным болезням, и изучили то, как она влияет на структуру этих белков. Результаты работы опубликованы в журнале International Journal of Molecular Sciences.
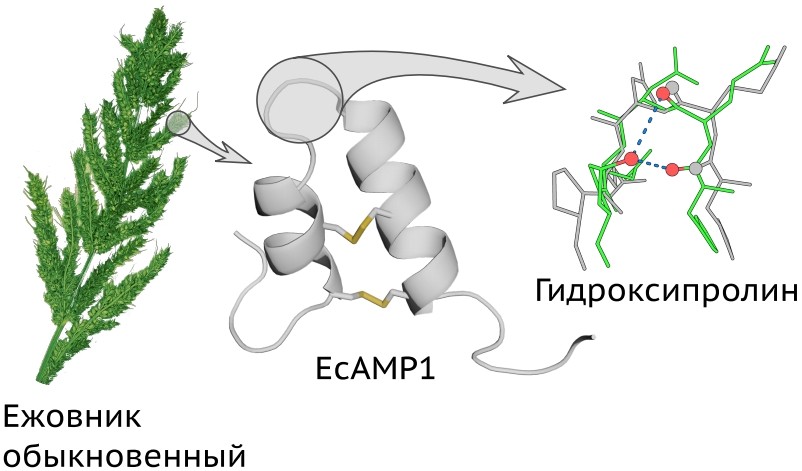
Все живые организмы имеют собственные защитные системы: у человека, например — многоуровневая иммунная система, связанная с выработкой антител. Один из растительных механизмов защиты связан с так называемыми пептидными «токсинами» — небольшими белками, которые помогают бороться с микробами, поражающими растения. Российские ученые обнаружили новый класс таких соединений около десяти лет назад. У этих пептидов есть структурная особенность — две спирали, соединенные несколькими жесткими сшивками.
«В этой работе наши коллеги из группы Евгения Рогожина в ИБХ РАН обнаружили, что растение добавляет к аминокислоте пролину в пептиде гидроксил, и получается гидроксипролин», — рассказал один из авторов статьи Артур Залевский, младший научный сотрудник лаборатории интерактомики Московского государственного медицинского университета имени И.М. Сеченова.
У человека и животных гидроксипролин часто встречается в белках соединительных тканей, например, в коллагене. Сам по себе этот результат не является абсолютно приоритетным, так как ранее данная модификация уже была описана для других защитных белковых молекул растений, однако именно для данного семейства обнаружена впервые. Задачей ученых было понять, какова роль гидроксипролина в пептидных токсинах.
В ходе работы ученые использовали методы масс-спектрометрии и белкового секвенирования, с помощью которых удалось обнаружить измененный токсин и определить тип модификации. Далее они синтезировали такой аналог и проверили его биологическую активность. Оказалось, что он менее действенен против микроскопического гриба Fusarium solani, который вызывает гниль клубней картофеля, плодов томата и зерновых злаков. При этом биологи надеялись, что он, наоборот, окажется активнее в несколько раз, поэтому они продолжили исследования и определили структуру нативного (немодифицированного) и измененного токсина на суперкомпьютере. При более детальном рассмотрении авторы обнаружили, что подвижность петли существенно уменьшилась. Выяснилось, что благодаря химической модификации образуется дополнительная водородная связь, которая как бы «утягивает» петлю, фиксируя ее в определенной конфигурации, которая, в свою очередь, преимущественно определяет способность к узнаванию мишени и, соответственно, активность.
«Таким образом, соединив экспериментальные и вычислительные методы, мы обнаружили важный инструмент, с помощью которого растение может тонко регулировать активность пептидов этого семейства, и лучше поняли определяющую роль именно структуры петли в активности пептида. Сейчас мы продолжаем работу с другими вариантами токсинов этого семейства («так называемыми «мутантами»), чтобы лучше понять, как различные модификации будут влиять на их структуру и функции», — добавил учёный.
Благодаря общей простоте устройства, пептидные «токсины» представляют собой интересную основу для инженерных манипуляций. Авторы планируют на молекулярном и субмолекулярном уровнях изучить принципы работы этих токсинов, комбинируя экспериментальные и вычислительные методы. Затем полученные данные можно использовать как матрицу для создания новых терапевтических молекул, например, антикоагулянтов — веществ, препятствующих образованию тромбов — или ингибиторов ВИЧ-интегразы, которые препятствуют встраиванию наследственного материала ДНК в хромосому клетки-хозяина.
Работа проходила в сотрудничестве с учеными из Института биоорганической химии РАН имени академиков М.М Шемякина и Ю.А. Овчинникова и Московского государственного университета имени М. В. Ломоносова.
Источник: Артур Залевский
