Ученые предложили новый способ оценивать поляризацию митохондрий
Исследователи из Сеченовского Университета совместно с коллегами из Ирландии разработали новый метод изучения поляризации митохондрий в живых клетках и тканях. Он хорошо дополняет существующие подходы и позволяет оценивать состояние митохондрий, изучать клетки в тканях и моделях органов. Исследование опубликовано в журнале Cytometry Part A.
Митохондрии играют важную роль в жизни клетки, снабжая ее энергией, участвуя в регулировании клеточного цикла и процессах программируемой клеточной смерти. Однако возможности ученых по наблюдению за количественными изменениями в митохондриях все еще довольно ограничены. Один из методов, позволяющих глубже взглянуть на функцию митохондрий, – это визуализация времени жизни флуоресценции, или флуоресцентная время-разрешенная микроскопия (Fluorescence Lifetime Imaging Microscopy, FLIM). Этот метод использует тот факт, что продолжительность свечения флуоресцентных красителей, молекулярных проб, белков и наночастиц зависит от их микроокружения, полярности среды, температуры и прочих факторов. Современные FLIM-микроскопы позволяют оценивать длительность свечения с точностью до долей наносекунд, и получать двух- и трехмерные изображения живых тканей, клеток или моделей органов. Метод уже активно используется в изучении снабжения кислородом тканей и клеток, изменений кислотности и окислительно-восстановительного баланса внутри клетки.
Авторы статьи обнаружили, что несколько известных красителей (в том числе метиловый эфир тетраметилродамина и красители группы SYTO) могут существенно дополнить традиционные методы изучения митохондрий в режиме FLIM.
«Работа началась с неудачных попыток использовать зеленые флуоресцентные краски типа SYTO для анализа организации ДНК в живой клетке методом FLIM: к нашему удивлению, большинство красителей накапливались не только в ядре, но и вне его, в митохондриях, причем в зависимости от мембранного потенциала клеток. Неожиданно наша работа получила новое, гораздо более интересное направление», – рассказал руководитель работы, ведущий научный сотрудник Института регенеративной медицины Сеченовского университета Руслан Дмитриев.
Авторы статьи обнаружили, что по продолжительности флуоресценции можно отслеживать поляризацию митохондрий (изменение заряда их мембраны), что позволяет точнее различать типы клеток, наблюдать за работой митохондрий и содержанием кислорода в клетке. Так, с помощью FLIM ученые показали, как заряд мембраны повышается на границе между G1 и S фазами клеточного цикла – в тот момент, когда клетка «решает», делиться ей или нет. Нарушение клеточного цикла напрямую связано со снижением способности ткани обновляться (старением), а также делением опухолевых клеток.
Возможности FLIM значительно возрастают, если перейти к более сложным, трехмерным моделям тканей, например, «органоидной» культуре тонкого кишечника. Такой «мини-кишечник» представляет собой многоклеточную структуру с полным набором всех типов клеток эпителия кишечника (включая стволовые, энтероциты, клетки Панета, энтероэндокринные и другие типы). Органоидная культура позволяет изучать развитие и функционирование кишечника, его взаимодействие с микрофлорой, лекарствами и другими веществами и может применяться в исследованиях диабета, колита и раковых заболеваний. Авторы обнаружили, что метод FLIM превосходно подходит для анализа органоидной тканевой культуры и дополняет уже существующие подходы по обнаружению стволовых клеток и оценке их способности к делению. Так, в режиме FLIM на основе поляризации митохондрий и фазы их клеточного цикла ученые выявили разные субпопуляции стволовых клеток внутри стволовой ниши. В то же время, анализ живых трехмерных объектов с помощью метода 3D-FLIM требует улучшенных алгоритмов по обработке данных и более требователен к выбору микроскопа.
Описанный подход открывает новые перспективы в развитии технологий культивирования стволовых клеток и оценке их качества, стимулирует развитие тканеинженерных подходов и методов микроскопии (применительно к другим моделям органов и тканей, полученных in vitro), а также будет полезен в фундаментальных исследованиях стволовых клеток.
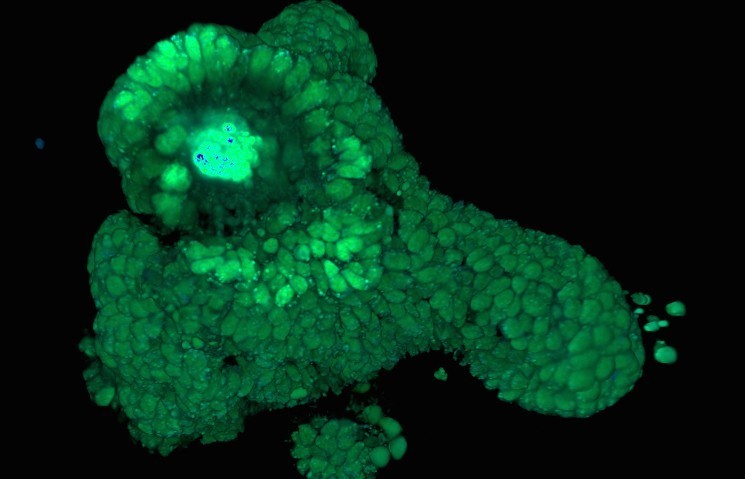
Трехмерная реконструкция клеточных ядер и митохондрий в кишечном органоиде, полученная с помощью двухфотонной FLIM микроскопии.
Источник: Руслан Дмитриев.








